メンバー
 |
福永 浩司 |
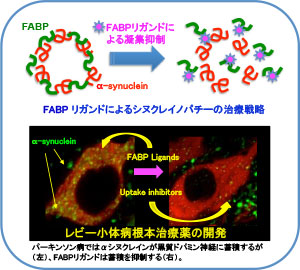
レビー小体病(パーキンソン病を含む)は認知症患者の約20%を占め、予後の悪い疾患です。αシヌクレインの凝集体および封入体が神経細胞体の神経細胞内に蓄積して神経変性を起こす疾患で、原因治療薬はありません。私達は黒質ドパミン神経細胞および大脳皮質神経細胞に高発現する脂肪酸結合蛋白質3(FABP3)がαシヌクレインと結合し、凝集体形成を促進すること、アラキドン酸がその凝集体形成を促進することを発見しました1)。さらに、 FABP3 の機能を阻害する低分子化合物(リガンド)を創製し、αシヌクレインとの結合を阻害することで凝集を抑制することを確認しました(2016年3月特許出願)。
1) Shioda N and Fukunaga K et al. FABP3 protein promotes α-synuclein oligomerization associated with 1-methyl-1,2,3,6-tetrahydropiridine (MPTP)-induced neurotoxicity. J. Biol. Chem. 289, 18957-18965 (2014)
 |
武田 篤 |
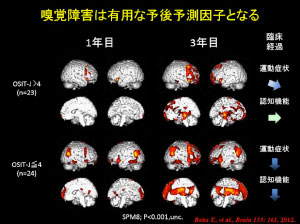
パーキンソン病やレビー小体型認知症を含むレビー小体病は運動機能障害から認知機能障害まで幅広い症候を示し、アルツハイマー病に次いで多い神経変性疾患です。ドパミン時補充療法等の進歩により運動症状の改善はある程度得られる様になったものの、進行とともに薬効は次第に低下して行きます。未だ確立されていない根治療法の開発には病態機序や創薬研究とともに、適切な疾患サロゲートマーカーの研究が不可欠です。我々は重度の嗅覚低下が予後を大きく左右する認知症に先行することを明らかとしました。現在、重度嗅覚低下のあるパーキンソン病を対象として早期からアセチルコリンを補充する治療介入試験(Donepezil application for severe hyposmic-PD (DASH-PD) study)を進めています(UMIN000009958)。
1)Baba T., Kikuchi A., Hirayama K., Nishio Y., Hosokai Y., Kanno S., Hasegawa T., Sugeno N., Konno M., Suzuki K., Takahashi S., Fukuda H., Aoki M., Itoyama Y., Mori E., Takeda A., Severe olfactory dysfunction is a prodromal symptom of dementia associated with Parkinson’s disease: a 3-year longitudinal study, Brain 135:161-169, 2012.
 |
河田 康志 |
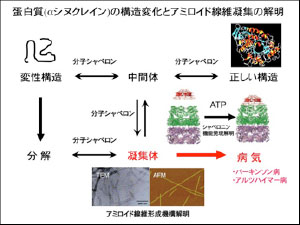
蛋白質の正しい立体構造形成は生体機能を維持する上で必須である。しかし,その「正しい構造」も様々な要因によって「中間体」を通り「変性構造」に変化しうる。このとき,しばしば「凝集体」が形成されることがある。このようにして生じる凝集体はアルツハイマー病やパーキンソン病を引き起こすことがあるが,生体内では分子シャペロンなどによって巧妙に制御されている。αシヌクレイン(Syn)のアミロイド線維凝集はレビー小体として蓄積されるが,どのように形成されるのか何が関与しているのかは未だ不明な点が多い。Synのアミロイド線維形成の分子メカニズムの蛋白質化学的な理解とそれらを制御する様々な因子との関係を明らかにし,病気の治療を目指したい。
・Ojha B., Fukui N., Hongo K., Mizobata T., and Kawata Y. Suppression of amyloid fibrils using the GroEL apical domain. Scientific Reports, 6, 31041 (2016)
 |
長谷川 隆文 |
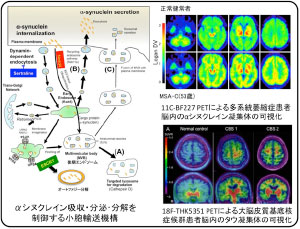
レビー小体の主要構成成分であるαシヌクレイン(αS)は、孤発性パーキンソン病(PD)発症過程において最も重要な役者と考えられています。αS遺伝子は点変異のみならず遺伝子重複(PARK4)でもPDを発症させることから、αS量増加そのものが神経変性の起点となると推定されています。我々は、神経・グリア細胞におけるαS吸収・分泌・分解を制御する小胞輸送機構を明らかにすることで、進行抑制治療の糸口を見つけたいと考え研究を続けています1)。さらに、将来の疾患修飾療法の候補絞り込みや効果判定に不可欠となるサロゲートマーカーとして、PETイメージングを駆使した脳内病変の可視化などにも積極的に取り組んでいます。
1) Oshima R, Hasegawa T., et al., ESCRT-0 dysfunction compromises autophagic degradation of protein aggregates and facilitates ER stress-mediated neurodegeneration via apoptotic and necroptotic pathways. Sci. Rep. 6:24997 (2016)
 |
大和田 祐二 |
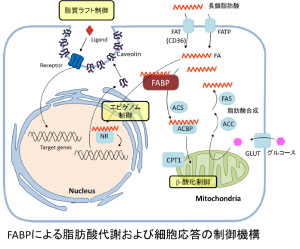
脳内脂質恒常性の変化は、高次脳機能や神経疾患病態と深く関連することが知られています。私たちは、脳に発現する細胞内の脂肪酸シャペロンである脂肪酸結合タンパク質(FABP)の遺伝子ノックアウトマウスにおいて、大脳皮質の神経細胞樹状突起形態や興奮性シナプス伝達に変化が生じていることを明らかにしました。さらにFABPが脂質ラフト関連遺伝子の発現調節を介して、神経系細胞の刺激応答を制御することを明らかにしました1)。今後、脳内の脂肪酸恒常性異常と神経変性とをつなぐ分子メカニズムをより詳細に明らかにすることで、レビー小体病をはじめとする神経変性疾患治療に向けて、有用な基礎的知見を提供できると考えています。
1) Ebrahimi M, Yamamoto Y, Sharifi K, Kida H, Kagawa Y, Yasumoto Y, Islam A, Miyazaki H, Shimamoto C, Maekawa M, Mitsushima D, Yoshikawa T, Owada Y. Astrocyte- expressed Fabp7 regulates dendritic morphology and excitatory synaptic function of cortical neurons. Glia 64, 48-62 (2016)